
Elementy ocynkowane i pasywowane w roztworze Lerapas® M po przeprowadzonym teście eksploatacyjnym (widoczne są wewnętrzne powierzchnie przylegających płytek bez białej korozji, z zachowaniem połysku)
Innowacyjny system zachowania połysku cynku
Cynkowanie ogniowe jest najlepszą metodą zabezpieczenia stali przed korozją. W wyniku zanurzeniowego procesu cynkowania ogniowego na powierzchni stali tworzy się metaliczna błyszcząca powłoka odporna na tarcie i uderzenia. Trwałość takiej powłoki wynosi, w zależności od warunków użytkowania, od 20–65 lat, niestety, utrata połysku cynku następuje szybciej. Stal ocynkowana cieszy się coraz większym zainteresowaniem wśród użytkowników, którzy dużą wagę przywiązują nie tylko do trwałej struktury, ale również do estetyki. W artykule przedstawiamy mechanizm powstawania białej korozji oraz sposoby utrzymania połysku cynku na elementach ocynkowanych.
Powłoka cynkowa wytworzona na drodze metalizacji zanurzeniowej (ogniowej) jest w naturalny sposób połączona z podłożem stalowym, powstając w wyniku reakcji ciekłego cynku z żelazem. Podczas zanurzenia wyrobu stalowego w kąpieli cynkowej na powierzchni generują się fazy stopowe Fe-Zn z cienką zewnętrzną fazą prawie czystego cynku (warstwa h). Tak powstała powłoka chroni stal przed korozją nie tylko w sposób mechaniczny jako bariera fizyczna przed wpływem środowiska, ale również protektorowo poprzez wytworzenie ogniwa galwanicznego.
Cynk charakteryzuje się w większości środowisk korozyjnych niższym potencjałem elektrochemicznym redoks niż żelazo. Anodą w tym układzie jest cynk, dlatego kationy cynku jako metalu bardziej elektroujemnego przechodzą do roztworu elektrolitu, aż do wyczerpania zapasów tego metalu. Z cynkowej anody uwalniane są jony cynku, które przyciągane są do żelaznej katody. Dzięki temu żelazo staje się odporne i nie koroduje. Każda powłoka dotknięta jest różnymi nieciągłościami i porami, przez które wilgoć przedostaje się do podłoża, dlatego efekt ochrony katodowej jest bardzo ważny, nawet bez widocznych wad powłoki. Należy pamiętać, że roztwarzanie elektrochemiczne cynku następuje znacznie wolniej niż żelaza, dlatego też całkowity czas ochrony stali w przypadku powłoki o grubości 70–80 µm trwa kilkadziesiąt lat. W tabeli nr 1 zestawiono wartości potencjałów elektrochemicznych wybranych pierwiastków metalicznych w zestawieniu z wodorem. Relacja ta przedstawiona została również na wykresie nr 1, przez co bardziej widoczne są różnice pomiędzy poszczególnymi potencjałami.
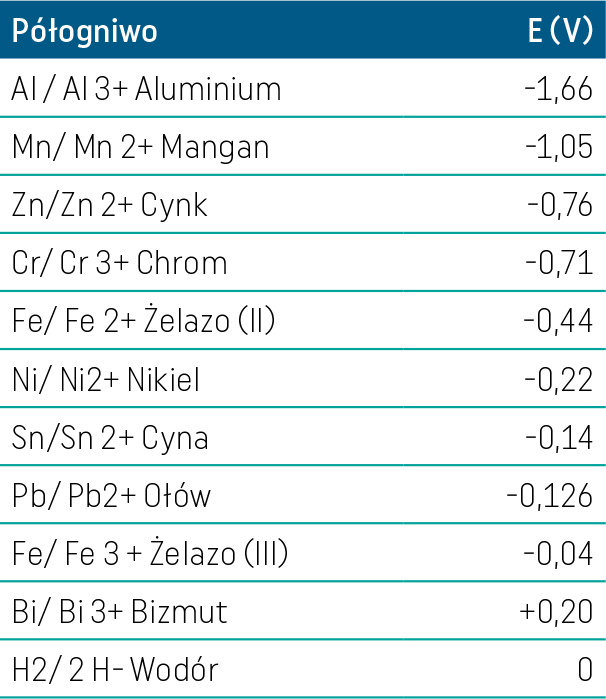
Tabela 1. Tabela potencjałów E (V) dla wybranych metali (Źródło: „Poradnik galwanotechnika”, praca zbiorowa, WNT, 2002)
Z przedstawionego wykresu wynika, że aluminium zawarte w powłoce cynkowej będzie najszybciej przechodziło w postać jonową, następnie mangan i cynk. Żelazo, które ma wartość potencjału wyższą w stosunku do tych pierwiastków, będzie katodą i nie będzie korodowało. Dodatki stopowe niklu, cyny, ołowiu i bizmutu mają potencjał wyższy w stosunku do żelaza. Czy zatem przeszkadzają w ochronie korozyjnej żelaza? Niewielkie ilości nie powinny znacznie wpływać na rozpuszczanie stopu w środowisku wodnym, ponieważ większość materiału powłokotwórczego stanowi cynk z dodatkiem aluminium. Na pewno należałoby to potwierdzić badaniami praktycznymi, jednakże obecność pierwiastków ma za zadanie poprawienie technologiczności kąpieli oraz kinetyki wzrostu powłoki ochronnej, dlatego ich obecność jest w pełni uzasadniona.













